Funkční řetězení povrchových receptorů na lidských imunitních buňkách
Mon Sep 26 10:58:32 CEST 2022
Mon Sep 26 10:58:32 CEST 2022 | Mon Sep 26 10:58:32 CEST 2022 - Mon Sep 26 10:58:32 CEST 2022
V prestižním časopise Nature Communications vyšla nová studie zabývající se strukturou a funkcí povrchových receptorů NK buněk. Autory studie jsou dva české vědecké týmy: Dr. Ondřeje Vaňka z Katedry biochemie Přírodovědecké fakulty Univerzity Karlovy a Dr. Jana Dohnálka z Biotechnologického ústavu AV ČR.
NK buňky (z angl. natural killer cells, přirození zabíječi) patří mezi bílé krvinky. Jejich název je odvozen od vrozené schopnosti zabíjet poškozené buňky v těle, např. rakovinné buňky nebo buňky napadené virem. K tomu, aby poznaly, zda je nějaká buňka poškozená, využívají kontakt mezi povrchovými receptory těchto buněk. Nově publikovaná studie přináší detaily kontaktů dvou konkrétních receptorů a nově osvětluje proces důležitý pro imunitní odpověď, konkrétně jak NK buňka získává signál, který dále vede k rozhodnutí “zabij” nebo “nech žít”.
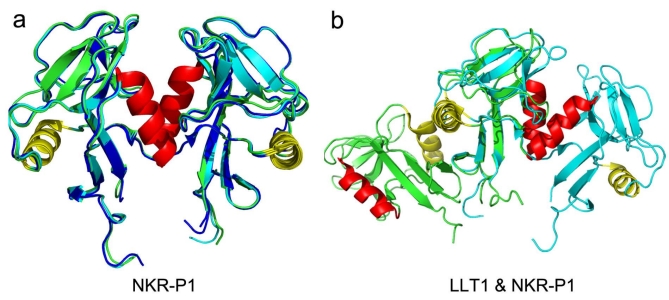
Publikace se věnuje interakci dvou proteinů. Prvním z nich je NKR-P1, povrchový receptor NK buněk. Tento receptor má zvláštní význam, protože slouží jako identifikátor, podle kterého je možné NK buňky rozeznat. Byl tedy už dávno laboratorně využíván, přestože to, jak vypadá jeho atomová struktura, objasnila až tato nová publikace. Druhým proteinem je LLT1, receptor, který se běžně nachází na povrchu různých cílových buněk. Pokud NK buňka rozpozná LLT1 na povrchu jiné buňky, je to pro ni signálem, že cílová buňka je v pořádku. Celé je to ale složitější. Bylo dokázáno, že LLT1 receptory jsou exprimovány i na povrchu rakovinných buněk, a tímto způsobem se rakovinné buňky brání imunitní odpovědi NK buněk.
Ilustrace: Receptory NKR-P1 na povrchu NK buněk interagují s povrchovými proteiny LLT1 na cílové buňce tak, že je umožněna tvorba delších molekulárních klastrů, připomínajících strukturu zipu (symbolický obrázek vlevo). Vpravo jsou zobrazeny molekuly NKR-P1 (odstíny modré) a LLT1 (odstíny zelené) jako molekulární povrch experimentálně určené struktury komplexu. Krčky molekul vnořené do buněčné membrány jsou znázorněny symbolicky.
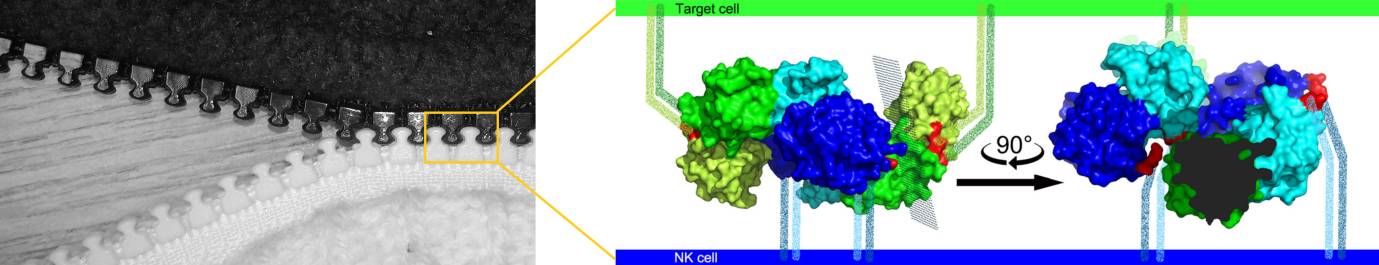
Tato nová studie poprvé přinesla detailní struktury obou proteinů NKR-P1 a LLT1 ve vzájemné interakci. Struktura byla objasněna pomocí rentgenové monokrystalové difrakce. Uspořádání v krystalu ukázalo, že obě molekuly střídavě tvoří řetězec podobný zipu (viz ilustrace): půlka dimeru NKR-P1 interaguje s půlkou dimeru LLT1, čímž vzniká prostor pro řetězení a tvorbu klastrů. Tvorba řetězce dává smysl, protože řetězení pomáhá zesílit interakci obou typů molekul, která je sama o sobě slabá. Hypotéza o vzniku klastrů takového typu není zcela nová, ale naše data přinesla první důkazy na atomární úrovni. Bylo třeba potvrdit, že se nejedná pouze o důsledek krystalizace, ale že i na povrchu buněk k řetězení tohoto typu dochází. To se podařilo prokázat pomocí dalších metod – superrozlišovací mikroskopie, kterou bylo možno zkoumat receptory přímo na povrchu buněk, a funkčních testů s živými NK buňkami izolovanými z krve dárců. Jednalo se o netriviální kombinaci několika metod. Bylo tedy ukázáno, jakým způsobem spolu musí NKR-P1 a LLT1 interagovat, aby NK buňka dostala inhibiční signál.
Výsledná akce buňky je závislá nejen na interakci těchto dvou proteinů, ale musí být ve shodě s dalšími signály z povrchu buňky, aby nevznikaly nechtěné imunitní reakce. I samotné klastrování v interakci NKR-P1 s LLT1 lze chápat jako evoluční pojistku proti falešným signálům.
Jan Dohnálek a Ondřej Vaněk


Teď tedy víme, jak na molekulární úrovni tyto interakce fungují. V budoucnosti nám tato znalost může pomoci ve vývoji terapeutických proteinů, které by ovlivnily interakci mezi imunitním systémem a rakovinnými buňkami.
Projekt byl realizován pod vedením týmu Dr. Ondřeje Vaňka z Laboratoře strukturní biochemie imunitního rozpoznávání PřF UK se zásadními příspěvky Dr. Jana Bláhy v podobě přípravy vzorků, jejich krystalizace a výpočetní analýzy strukturních dat, a Dr. Barbory Kalouskové v oblasti experimentů superrozlišovací mikroskopie a funkční analýzy NK buněk. Tým Dr. Jana Dohnálka z Laboratoře struktury a funkce biomolekul BTÚ přispěl vyřešením krystalových struktur a analýzou dat maloúhlového rentgenového rozptylu, s hlavním podílem Dr. Terezy Skálové na strukturních pracích.
